贝达药业BPI-16350药品联用获批开展临床试验
日期: 2021-06-17

6月17日,贝达药业收到国家药品监督管理局签发的《药物临床试验批准通知书》(通知书编号:2021LP00866、2021LP00867),公司申报的BPI-16350胶囊联合非甾体类芳香化酶抑制剂(来曲唑/阿那曲唑)或氟维司群治疗激素受体阳性、人类表皮生长因子受体2阴性(HR阳性/HER2阴性)晚期乳腺癌的Ⅰb/Ⅱ期临床试验申请已获国家药品监督管理局批准开展。
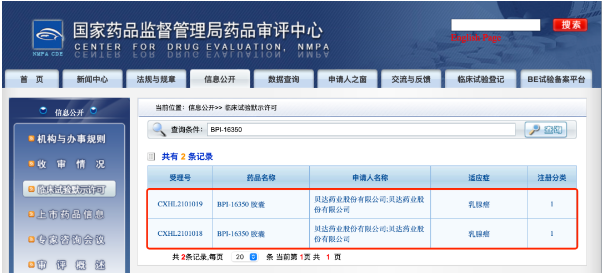
△BPI-16350药品联用获批开展临床试验
BPI-16350是一个全新的、拥有完全自主知识产权的新分子实体化合物,由贝达药业自主研发,针对的靶点为细胞周期蛋白依赖性激酶4/6(CDK4/6),拟单药或与激素疗法联合,主要用于治疗HR阳性/HER2阴性的晚期或转移乳腺癌患者,还可能用于Rb+的其他癌症的一、二线或联合治疗。CDK4/6是调节细胞周期的关键因子,能够触发细胞周期从生长期(G1期)向DNA复制期(S期)转变,CDK4/6抑制剂将细胞周期阻滞于G1期,从而起到抑制肿瘤细胞增殖的作用。
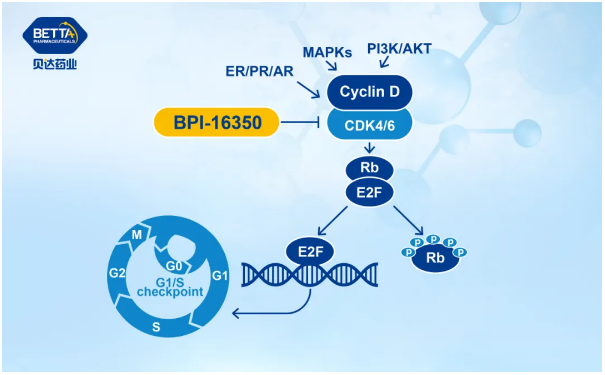
△BPI-16350作用机理图
临床前数据显示,BPI-16350在动物体内外生物学活性一致,能有效抑制多种实体瘤肿瘤细胞增殖,单药或联合用药在多个实体瘤模型上展现了良好的抗肿瘤作用,同时理化及药代动力学性质优秀。
2018年6月,BPI-16350获得国家药品监督管理局的批准开展单药用于晚期实体瘤的临床试验,目前Ⅰ期临床研究正在进行中。本次获批开展BPI-16350联合非甾体类芳香化酶抑制剂(来曲唑/阿那曲唑)或氟维司群治疗乳腺癌的临床试验,系对BPI-16350应用的又一个探索。
下一条: 贝达药业巴替利单抗(PD-1抗体)注射液获批开展临床试验
热门点击
