12月5日至7日,2025年欧洲肿瘤内科学会亚洲年会(ESMO Asia)在新加坡举行,会议由欧洲肿瘤内科学会(ESMO)主办。中山大学肿瘤防治中心马宇翔教授在会上口头报告了贝达药业靶向GARP/TGF-β复合物及PD-L1的三功能双特异性抗体BPB-101在局部晚期或转移性实体瘤患者中的I期临床研究结果。

△中山大学肿瘤防治中心马宇翔教授作口头报告
01研究背景
PD-1/PD-L1是当前最重要的免疫治疗靶点之一,但不少患者仍因肿瘤免疫抑制微环境而无法从治疗中获益。其中,TGF-β通路被认为是导致免疫耐药的关键机制。研究显示,同时阻断PD-L1与TGF-β有望发挥协同抗肿瘤作用,是突破免疫治疗瓶颈的重要方向[1-3]。BPB-101是全球首个同时靶向 GARP/TGF-β复合体、成熟的TGF-β及PD-L1 的三功能的双特异性IgG1亚型人源化抗体,可解除肿瘤微环境TGF-β信号轴和PD-1/PD-L1信号轴的双重免疫抑制,恢复并增强免疫细胞对肿瘤细胞的杀伤功效,从而抑制肿瘤的生长和存活。在临床前研究中,BPB-101展现出了优秀的体内外药效活性、良好的药代动力学及安全性[4]。本次大会公布的数据来自BPB-101在晚期实体瘤患者中的Ia期剂量递增研究,主要评估其安全性、药代动力学(PK)、药效动力学(PD)及初步疗效。
02研究方法
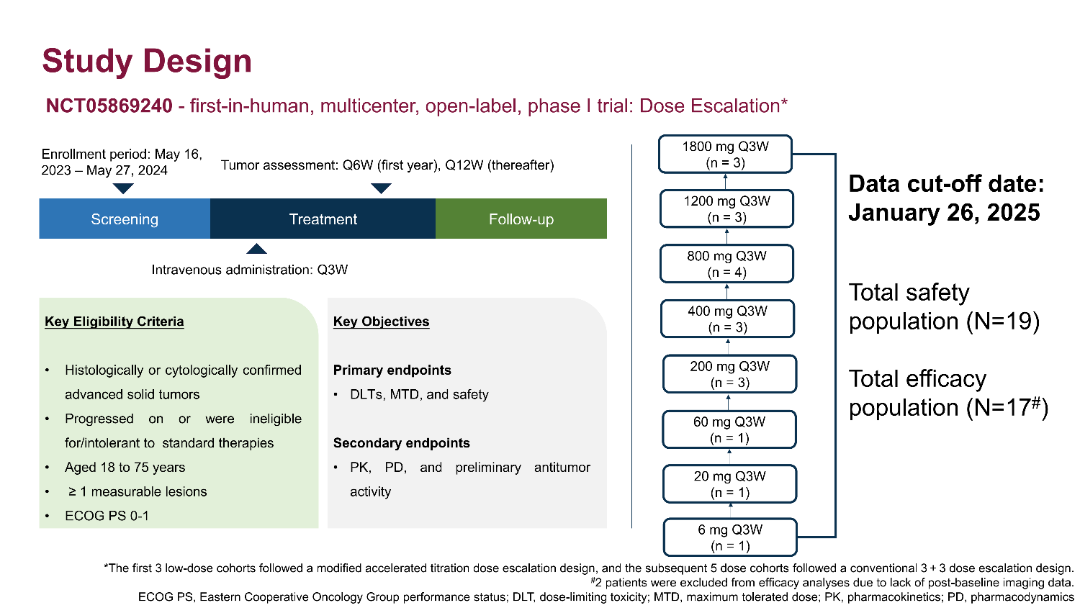
本研究是一项非随机、多中心、开放标签的Ia期剂量递增研究,共有4家国内医学中心参与,纳入标准为年龄在18-75岁,组织学或细胞学确诊的标准治疗失败或不耐受、或无有效标准治疗、ECOG PS 0-1的晚期实体瘤患者。入组患者接受递增剂量的BPB-101治疗(6 mg、20 mg、60 mg、200 mg、400 mg、800 mg、1200 mg和1800 mg),每3周给药1次(Q3W),直至患者出现疾病进展、无法耐受的毒性、或其他终止治疗标准。主要终点是BPB-101在晚期实体瘤患者中的剂量限制性毒性(DLT)、最大耐受剂量(MTD)和安全性,次要终点包括药代动力学(PK)、药效动力学(PD)和初步疗效。
03研究结果
2023年5月至2024年5月,共19例患者纳入研究。患者按剂量递增被分至多个剂量组:6 mg、20 mg、60 mg 各 1 例;200 mg、400 mg、1200 mg、1800 mg 各 3 例;800 mg 4 例。中位年龄为57.0岁(范围:27-69岁),其中65岁及以上患者占10.5%(2/19),非小细胞肺癌(NSCLC)为最常见肿瘤类型占42.1%(8/19),曾接受过免疫或靶向治疗的患者占89.5%(17/19)。

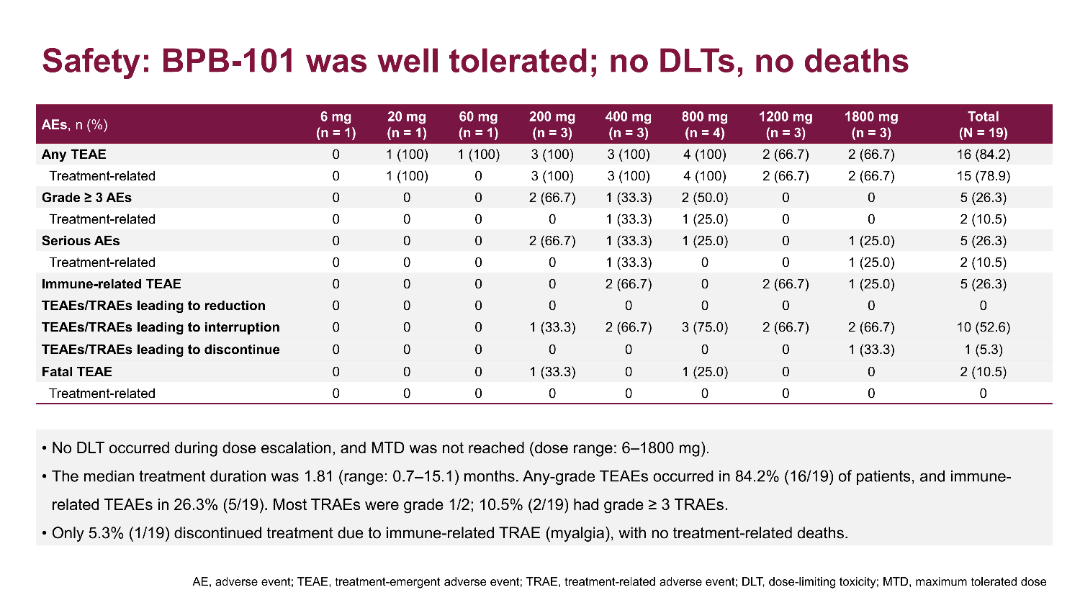
截至2025年1月26日,安全性分析显示,在全部19例患者中,未观察到DLT,且MTD暂未达到。78.9%(15/19)的患者出现治疗相关不良事件(TRAE),其中10.5%(2/19)的患者为≥3级TRAE。最常见的TRAE为输液相关反应(26.3%)和贫血(26.3%)。
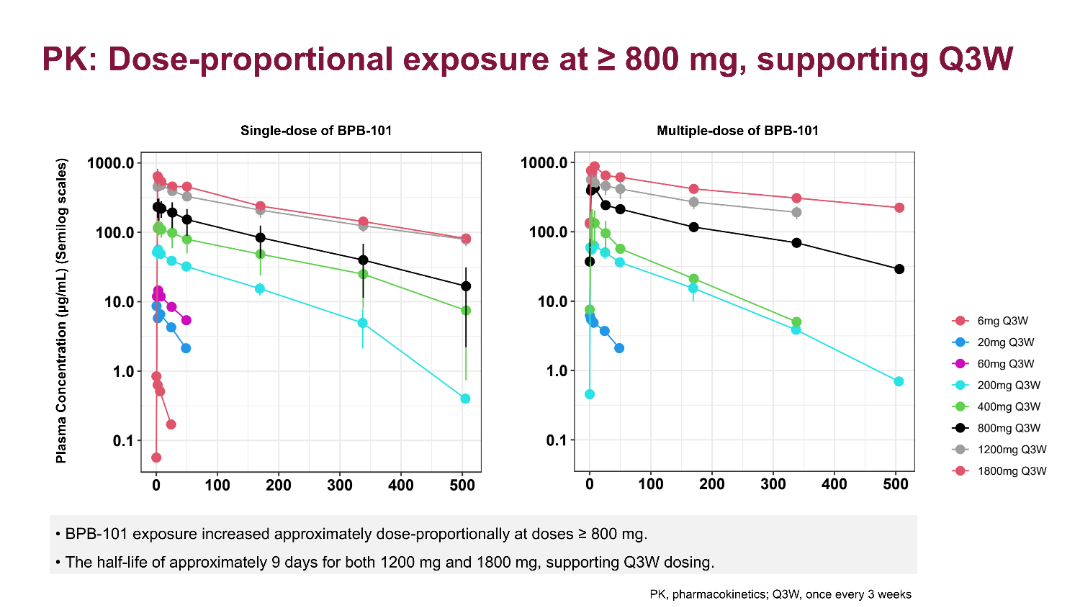
PK分析显示BPB-101在低剂量范围内表现出靶点介导的非线性药代动力学特征,而在≥800 mg Q3W剂量下则表现出近似剂量比例增加。PK/PD分析显示在所有接受≥1200 mg Q3W剂量治疗的患者中,PD-L1受体占有率和TGF-β抑制率均达到最大值。

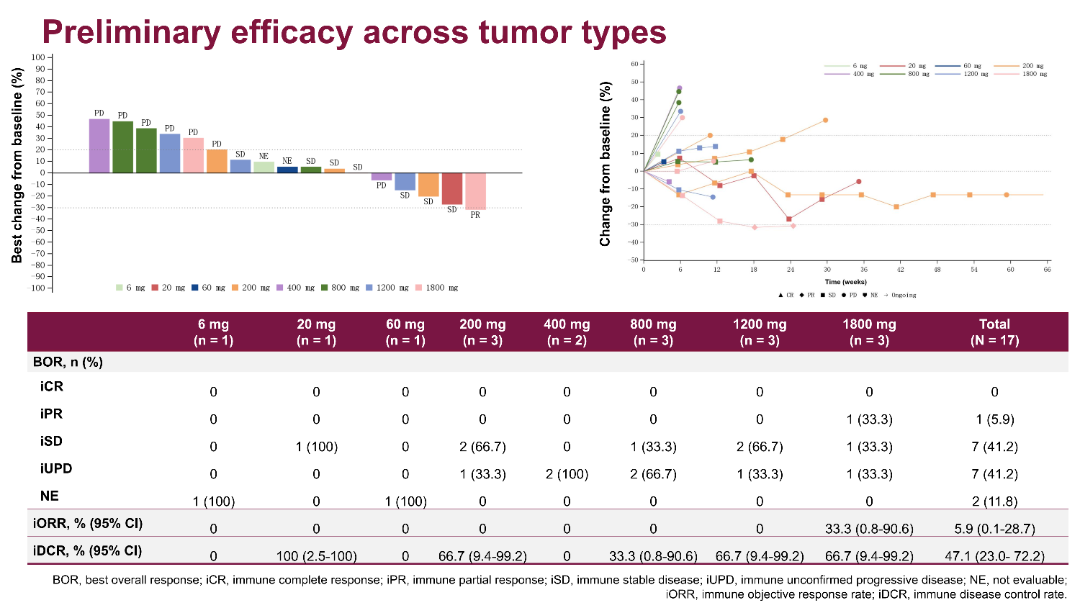
疗效分析显示在17例可评估疗效的患者中,整体客观缓解率(ORR)为5.9%(1/17),疾病控制率(DCR)为47.1%(8/17)。
04研究结论
BPB-101在晚期实体瘤患者中展现出良好可控的安全性和初步抗肿瘤活性。基于安全性及PK/PD结果,研究暂定推荐II期剂量(RP2D)为1200 mg或1800 mg(Q3W)。其潜在的抗肿瘤活性值得在后续扩展队列中进一步验证。
中山大学肿瘤防治中心马宇翔表示,作为中国自主研发、全球首个同时靶向 GARP/TGF-β复合物、活化TGF-β及PD-L1 的三功能抗体,BPB-101 的Ia期结果具有重要的临床探索价值。本研究在疾病负担较重的晚期实体瘤患者中,展现出了良好的安全性、明确的PK/PD活性信号及初步抗肿瘤效果。作为创新型三功能抗体,BPB-101 有望突破传统PD-1/PD-L1单抗的疗效瓶颈,为晚期实体瘤患者,特别是TGF-β高表达人群带来更精准的治疗方案。本研究的顺利推进,为后续扩展队列及II期验证奠定了坚实基础,也为中国在创新型免疫治疗领域贡献了重要的临床证据。
参考文献:
1. Gulley J L, Schlom J, Barcellos‐Hoff M H, et al. Dual inhibition of TGF‐β and PD‐L1: a novel approach to cancer treatment[J]. Molecular oncology, 2022, 16(11): 2117-2134.
2. Barlesi F, Isambert N, Felip E, et al. Bintrafusp alfa, a bifunctional fusion protein targeting TGF-β and PD-L1, in patients with non-small cell lung cancer resistant or refractory to immune checkpoint inhibitors[J]. The oncologist, 2023, 28(3): 258-267.
3. Feng J, Tang D, Wang J, et al. SHR-1701, a bifunctional fusion protein targeting PD-L1 and TGFβ, for recurrent or metastatic cervical cancer: a clinical expansion cohort of a phase I study[J]. Clinical Cancer Research, 2022, 28(24): 5297-5305.
4. Xu W, Xu J, Li P, et al. Discovery and preclinical evaluation of BPB-101: a novel triple functional bispecific antibody targeting GARP-TGF-β complex/SLC, free TGF-β and PD-L1[J]. Frontiers in Immunology, 2024, 15: 1479399.
下一条: 贝达药业盐酸恩沙替尼欧洲上市申请获受理
