近日,贝达药业收到国家药品监督管理局签发的《受理通知书》(受理号:JXHL2300237、JXHL2300238),公司从C4 Therapeutics, Inc. (C4T)引进的CFT8919片携带EGFR突变的非小细胞肺癌患者适应症临床试验申请获国家药品监督管理局受理。
今年7月,C4T收到了美国食品药品监督管理局签发的《药物临床试验批准通知书》,允许CFT8919片在美国开展Ⅰ/Ⅱ期临床试验。CFT8919片是公司从C4T引进的一种具有口服生物利用度的变构 BiDAC™ 降解剂,对携带EGFR外显子21(L858R)突变具有良好的活性和选择性,同时对T790M或C797S突变的EGFR继发耐药突变有效。
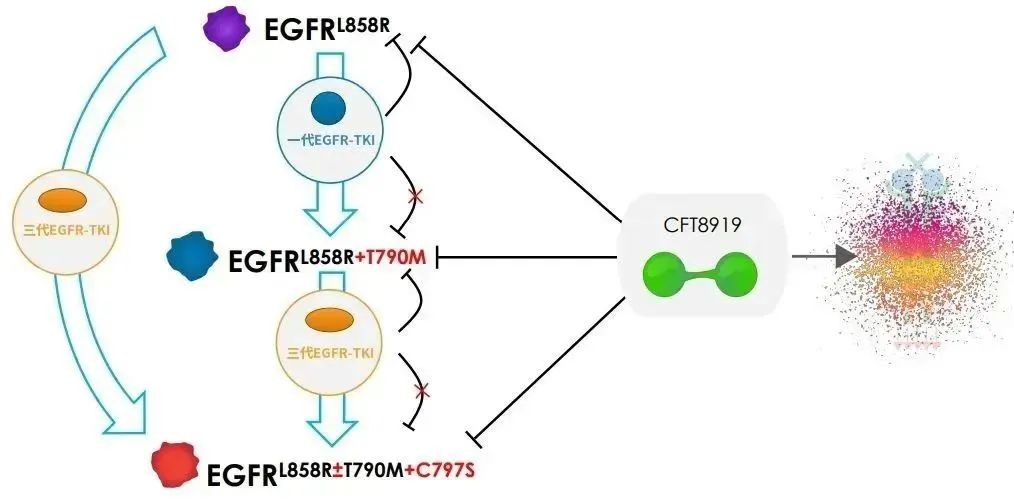
△CFT8919作用机理图(来源:C4T)
多个大型随机对照试验亚组分析结果显示,一代、二代和三代EGFR-TKI治疗19del和21L858R突变患者显示出了不同的疗效,总体来看,19del突变患者的获益要明显高于21L858R突变的患者。对于携带21L858R突变NSCLC患者,临床上仍存在较大的未满足需求,期待更好的治疗方案。
贝达药业副总裁、项目总负责人王三虎表示,临床前研究中,CFT8919片在EGFR L858R 驱动的NSCLC 的体内外模型中具有活性,可靶向广泛的在靶耐药突变并有颅内活性,具有预防或治疗患者脑转移的潜力。贝达从C4T 引进的CFT8919片能为EGFR L858R 突变患者提供崭新的治疗选择,造福广大患者。
贝达药业董事长丁列明表示,CFT8919片是公司在靶向蛋白降解领域的一次探索,公司已有一代、三代EGFR-TKIs上市产品,以及四代EGFR-TKIs、EGFR/cMET双抗产品管线,在EGFR突变的非小细胞肺癌领域积累了丰富的经验,为助力CFT8919片后续研发奠定了坚实基础。亚洲EGFR L858R突变患病人群较多,存在较大的未被满足的临床用药需求。期待CFT8919片早日开展临床研究,为全球患者提供新的治疗选择。
下一条: 中央统战部副部长、国侨办主任陈旭一行调研贝达药业
