新闻中心 / News Center
贝达药业第四代EGFR抑制剂BPI-361175 在美国获批临床
日期: 2021-12-05
近日,贝达药业收到美国食品药品监督管理局(FDA)签发的新药临床试验批准通知书,公司申报的 BPI-361175 片用于治疗携带 EGFR C797S 突变及其他 EGFR 相关突变的非小细胞肺癌的药品临床试验申请已取得美国FDA批准。
BPI-361175 是一个由贝达药业自主研发的拥有完全自主知识产权的新分子实体化合物,是一种新型强效、选择性的第四代表皮生长因子受体(Epidermal growth factor receptor, EGFR)口服小分子抑制剂,拟治疗携带EGFR C797S 突变及其他 EGFR 相关突变的非小细胞肺癌。
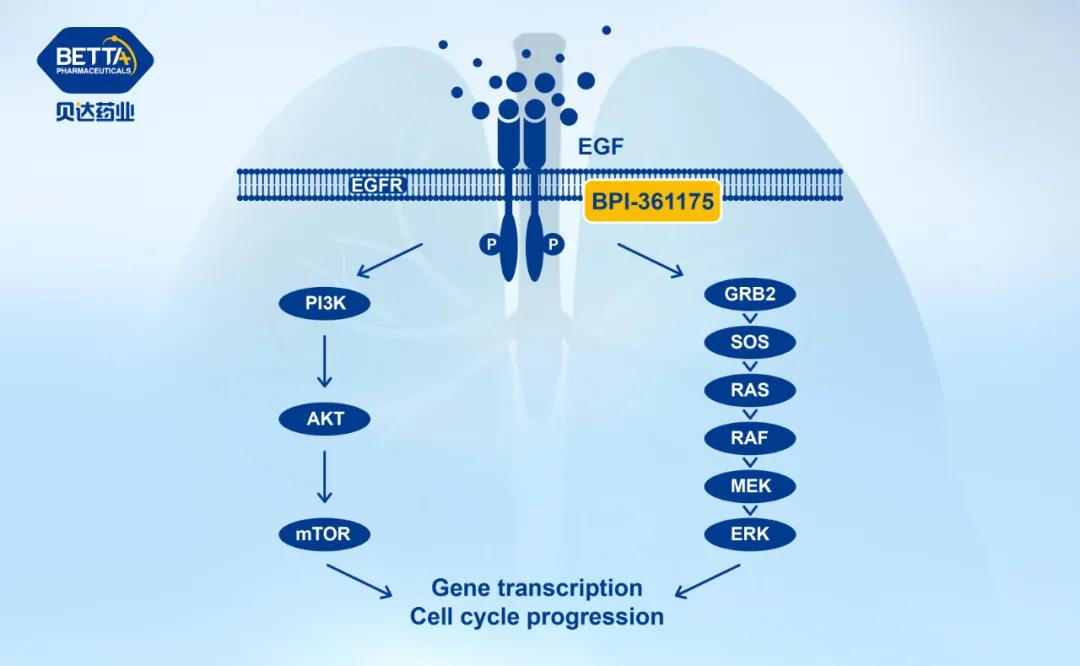
△BPI-361175作用机理图
临床前研究结果显示,BPI-361175具有良好的抗肿瘤活性、安全性、耐受性和药代动力学特征,或可进一步改善耐药、提升疗效,满足迫切的临床需求。目前,国内外针对携带 EGFR C797S 突变的药物均处于临床前或早期临床阶段,尚无药物上市。今年2月, BPI-361175获国家药品监督管理局批准开展临床试验,8月该项目I期临床研究第一例受试者成功入组,顺利完成首次给药。BPI-361175 在美国属于505(b)(1)途径上市产品。
贝达药业副总裁兼CMC负责人刘福强博士表示,很高兴看到贝达药业首个向美国FDA递交的IND申报顺利获批临床,这对贝达的发展具有里程碑式的意义。贝达有丰富的自主研发产品管线,是国内肿瘤领域特别是肺癌靶向药物领域的领军企业之一。希望今后贝达有更多的自研产品走向海外,拓展国际市场,为更多患者服务。
下一条: 贝达药业盐酸恩沙替尼(贝美纳®)列入国家医保目录
热门点击
