2021年6月4日,贝达药业收到国家药品监督管理局(NMPA)核准签发的《药品注册证书》(药品批准文号:国药准字H20110061),盐酸埃克替尼作为Ⅱ-ⅢA期表皮生长因子受体(EGFR)突变非小细胞肺癌(NSCLC)术后辅助治疗的新适应证获批上市,这是埃克替尼获批的第三项适应症。埃克替尼术后辅助治疗是全球第一个一代EGFR-TKI术后辅助靶向治疗非小细胞肺癌适应症,埃克替尼成为第一个用于II-IIIA期肺癌EGFR突变患者术后辅助治疗的国产药物。

盐酸埃克替尼(凯美纳®)是贝达药业历时近十年自主研发、完全拥有自主知识产权的国家1.1类创新药,也是中国第一个自主创新的小分子靶向抗癌新药。它是一种强效、高选择性的小分子口服表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。2011年6月7日,盐酸埃克替尼获得国家食品药品监督管理总局批准上市,用于非小细胞肺癌(NSCLC)二/三线的治疗,填补了我国小分子靶向抗癌药物的空白,被誉为堪比民生领域“两弹一星”的重大科技成果。2014年11月13日,国家食品药品监督管理总局批准单药适用于治疗表皮生长因子受体(EGFR)基因具有敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。
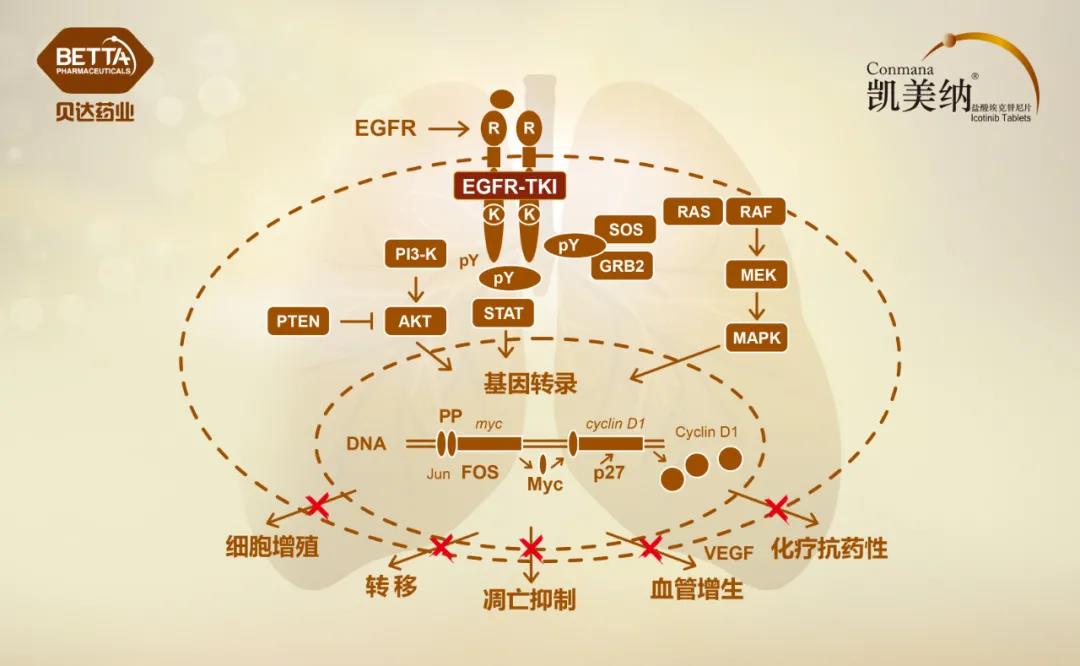
△盐酸埃克替尼作用机理图
埃克替尼上市后开展了80多项临床研究,包括一线治疗研究、肺癌伴脑转移研究、EGFR状态不明患者研究、EGFR21L858R外显子敏感突变加量研究、与化疗联合的研究等。其中,EVIDENCE是NSCLC领域第一个术后辅助靶向治疗注册临床研究。

关于EVIDENCE研究
EVIDENCE研究是一项将埃克替尼和标准辅助化疗进行头对头比较,用于Ⅱ-ⅢA期伴EGFR敏感突变NSCLC术后辅助治疗的多中心、随机、开放Ⅲ期研究,由同济大学附属上海市肺科医院周彩存教授和广州医科大学附属第一医院何建行教授共同牵头开展。在研究设计方面,EVIDENCE研究允许选择培美曲塞联合铂类作为标准化疗组的可选方案,同时化疗组患者疾病复发后,允许免费交叉接受埃克替尼治疗。EVIDENCE研究的主要终点为无病生存期(DFS),次要终点包括总生存期(OS)和安全性等。
在今年1月底召开的2020年世界肺癌大会上,EVIDENCE研究结果重磅公布。结果显示:在疗效方面,埃克替尼治疗组对比标准辅助化疗组,患者中位无病生存期(DFS)为46.95个月 vs 22.11个月,(P<0.0001);3年DFS率为63.88% vs 32.47%;在安全性方面,埃克替尼治疗组不良反应发生率明显低于标准辅助化疗组,3级及以上不良反应发生率为4.49% ,标准化疗组为59.71%。>>>>点击查看详情
广州医科大学附属第一医院何建行教授表示,作为肺癌外科医生,一直期待对EGFR阳性人群(中国约占50%)有替代术后辅助化疗,更有效低毒方案获批,尤其在靶向治疗领域。EVIDENCE临床研究结果具有里程碑意义,进一步证实了靶向治疗在EGFR敏感突变非小细胞肺癌患者辅助治疗中的地位。埃克替尼成为第一个证实II-IIIA期EGFR突变NSCLC在完成肿瘤切除后接受埃克替尼辅助治疗患者的DFS显示出统计学显著改善和临床获益的国产靶向药物。
贝达药业副总裁兼临床管理和医学事务负责人季东表示,EVIDENCE研究证实,埃克替尼用于EGFR基因敏感突变的NSCLC患者术后辅助治疗的疗效显著优于标准辅助化疗,同时安全性较化疗更优。研究为埃克替尼针对携带EGFR敏感突变非小细胞肺癌患者的术后辅助治疗提供了重要的循证依据。
贝达药业副总裁马勇斌表示,从二/三线治疗到一线治疗,再到如今可手术肺癌患者治疗适应症获批上市,埃克替尼的高效治疗潜力被不断挖掘。埃克替尼新适应症成功上市,离不开公司各部门的紧密合作,离不开监管部门、临床专家的指导支持。未来,在我国医药产业政策引领下,贝达药业将进一步提升自主创新能力,造福更多患者。
贝达药业资深副总裁兼首席运营官万江表示,埃克替尼上市以来已经有28万多名肺癌患者服用,并且持续开展后期免费用药项目,累计发药600多万盒,市场价值超100亿元,切实降低了患者负担。目前埃克替尼已经纳入国家医保药品目录,此次术后辅助治疗新适应证获批之后,将保留赠药,减轻患者经济负担,让患者用药无忧。
下一条: 贝达药业埃克替尼和伏罗尼布临床研究成果亮相ASCO年会
