
9月16日-21日,2021年欧洲肿瘤内科学会(ESMO)年会-虚拟会议举行。贝达药业甲磺酸贝福替尼(BPI-D0316)和贝伐珠单抗注射液(MIL60)临床研究成果以壁报形式在会议上展示。
评估贝福替尼对比埃克替尼作为在既往未经治疗的EGFR敏感突变局部晚期或转移性非小细胞肺癌患者一线治疗中的疗效和安全性的III期临床研究

01 研究背景
研究显示表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)在治疗晚期EGFR突变方面比化疗展现出更好的疗效。然而,大多数患者在接受第一代/第二代EGFR-TKIs治疗后会出现不同程度的耐药性。贝福替尼(Befotertinib) 是第三代EGFR-TKI,对EGFR敏感突变(19号外显子缺失和21号外显子L858R突变)或T790M突变具有选择性。该疗效已在II期研究(NCT03861156)中得到证实。该研究报告表明,在接受一代EGFR-TKI治疗出现疾病进展并已确诊为EGFR T790M突变的非小细胞肺癌患者中,接受贝福替尼治疗后,患者客观应答率(ORR)为64.8%,疾病控制率(DCR)为95.2%。基于上述研究成果,我们开展了一项多中心、随机、开放、平行对照的III期研究(NCT04206072),以评估贝福替尼对比埃克替尼(icotonib)作为在既往未经治疗的EGFR敏感突变局部晚期或转移性非小细胞肺癌患者一线治疗中的疗效和安全性。
02 患者入选标准
本研究采用优效设计,研究纳入年龄≥18岁局部晚期或转移性非小细胞肺癌EGFR突变阳性(19号外显子缺失或21外显子L858R突变,两者单独存在或与其他EGFR位点突变共存均可)的未接受治疗的患者。
03 研究方案
符合条件的患者将被随机分配到服用埃克替尼(口服125 mg Tid)或贝福替尼 (75 mg QD; 21天/周期。治疗1个周期后,若未发生CTCAE 4.03≥2级的血小板降低或头痛,则升高剂量至100 mg QD,否则将维持75 mg QD),直至出现疾病进展(RECIST v1.1),满足退出标准或研究终止标准。
04 研究终点
主要终点是由独立审查委员会评估的无进展生存期(PFS)。次要终点是客观缓解率、疾病控制率、颅内客观缓解率(iORR)、颅内无进展生存期(iPFS)、总生存期(OS)、缓解持续时间(DOR)和安全性。
05 统计分析
本研究贝福替尼组和埃克替尼组人群皆为既往未经治疗的EGFR敏感突变局部晚期或转移性非小细胞肺癌患者,样本量是在假设风险比(HR)为0.625情况下指定的。相应的PFS由埃克替尼组预期的10个月增加到贝福替尼组的16个月,检验效能取86%,检验水准单侧取0.025,20%的脱落率。
06 目前进展
这项研究已在中国的40家中心进行。截至2020年12月18日,患者招募工作已完成。患者数据目前正在随访。
评估MIL60联合紫杉醇/卡铂与贝伐珠单抗联合紫杉醇/卡铂治疗晚期或复发性非鳞状细胞非小细胞肺癌(NSCLC)初治受试者的有效性和安全性的III期临床研究
01 研究方案
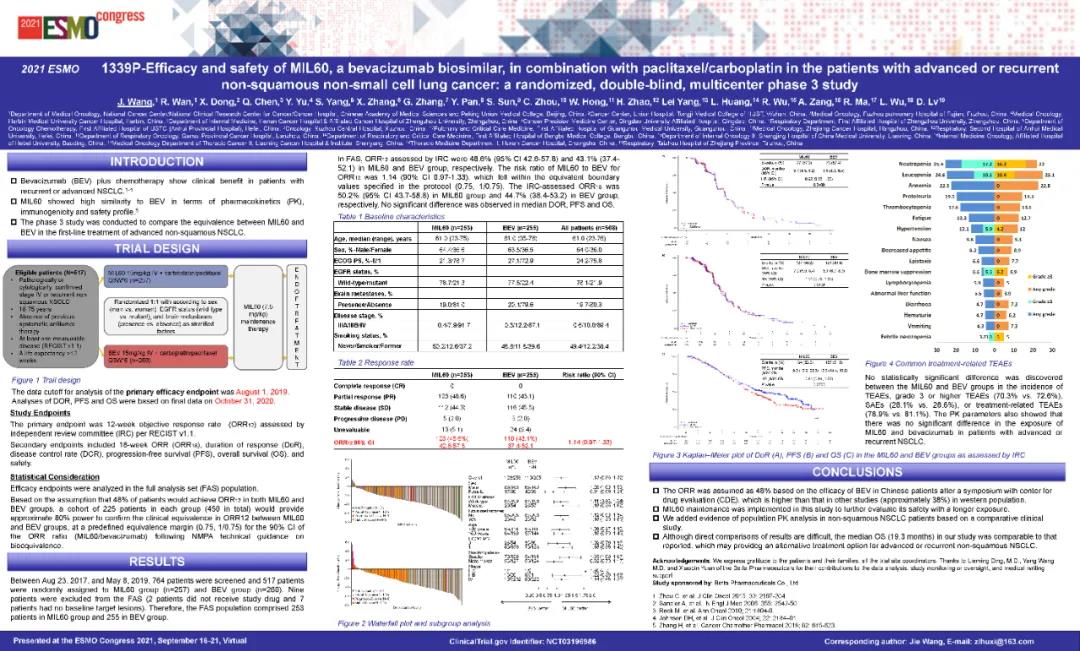
MIL60是贝伐单抗的生物类似药,可结合和抑制血管内皮生长因子。本研究是一项随机、双盲、多中心、阳性药对照的III期临床研究(NCT03196986),主要评估MIL60联合紫杉醇/卡铂与贝伐珠单抗联合紫杉醇/卡铂治疗晚期或复发性非鳞状细胞非小细胞肺癌(NSCLC)初治受试者的有效性和安全性。主要终点是比较两组治疗晚期或复发性非鳞状细胞NSCLC患者12周的客观缓解率(ORR12)。次要终点包括18周的客观缓解率(ORR18)、缓解持续时间(DOR)、无进展生存期(PFS)、疾病控制率(DCR)和总生存期(OS)。探索性目的包括群体药代动力学(Pop PK)特征和免疫原性。
以1:1的比例随机分配到MIL60(15 mg/kg)联合紫杉醇+卡铂治疗组(MIL60组)或贝伐珠单抗(15 mg/kg)联合紫杉醇+卡铂治疗组(BEV组)中,分层因素包括性别、表皮生长因子受体(EGFR)基因状态(野生型vs突变型),以及有无脑转移。本研究计划入组510例受试者,MIL60组和贝伐珠单抗组各入组255例。研究间期每例受试者接受每3周(±3天)为一个治疗周期的治疗,随后进行MIL60单药(7.5mg/kg)维持治疗,直至出现PD、无法耐受的毒性反应、采用其他抗肿瘤治疗、撤回知情同意、失访、死亡或整个研究结束。
02 研究结果
2017年8月23日至2019年5月8日,517名患者被随机分为MIL60组(n=257)和BEV组(n=260)。
在全分析人群(FAS)中,截止到2019年8月1日,MIL60组和BEV组的ORR12分别为48.6%和43.1%。两组IREC评估的ORR12比值(含分层因素)为1.14,其90% CI为(0.970,1.332),在预先规定的等效边界内(0.75-1/0.75)。
次要终点分析基于2020年10月31日的更新数据。MIL60的中位DOR为5.7个月(95% CI 4.5-6.2),BEV的中位DOR为5.6个月(95% CI 4.3-6.4)。中位PFS(7.2个月vs. 8.1个月;HR 1.01,95% CI 0.78-1.30,p=0.9606)和OS(19.3个月vs. 16.3个月;HR 0.81,95% CI 0.64-1.02,p=0.0755)无显著差异。两组的安全性和耐受性相似。
MIL60组和BEV组的不良事件(TEAE)(99.6% vs. 98.8%)和不良反应(TRAE)(78.9% vs. 81.1%)相似。3级及3级以上TEAE(70.3% vs. 72.6%)、3级及3级以上TRAE(34.4% vs. 39.0%)、严重不良事件(SAE)(28.1% vs 28.6%)、与MIL60/贝伐珠单抗相关的SAE(15.2% vs 16.2%)、导致死亡的TEAE(2.0% vs 1.9%)均无显著差异。
MIL60和贝伐珠单抗在血浆中的暴露量[AUC和达峰浓度(Cmax)]无显著性差异,说明MIL60和贝伐珠单抗在晚期或复发性非鳞状细胞NSCLC受试者中具有相似的Pop PK的特征。
MIL60组和贝伐珠单抗组均无受试者在接受研究药物后出现ADA阳性。对所有ADA阳性的受试者均进行了NAb检测,检测结果均为阴性。
03 结论
MIL60与BEV治疗非鳞状NSCLC的临床疗效相当,其安全性、Pop PK和免疫原性与BEV相似。
下一条: 2021 WCLC: 恩沙替尼国内注册Ⅱ期临床ctDNA探索性研究最新结果公布
