11月19日,贝达药业收到国家药品监督管理局签发的《药物临床试验批准通知书》,公司申报的注射用MCLA-129拟用于“晚期实体瘤(包括但不限于野生型结直肠癌、肝癌、头颈鳞癌、胰腺癌、原发不明腺癌以及鳞癌等晚期实体瘤)”的临床试验申请已获国家药品监督管理局批准。

注射用MCLA-129是一款针对表皮生长因子受体(EGFR)和细胞间质上皮转化因子(c-Met)双靶点的双特异性抗体,可同时阻断EGFR和c-Met的信号传导,抑制肿瘤的生长和存活,且可经增强的抗体依赖的细胞介导的细胞毒性作用(ADCC)进一步提高对肿瘤细胞的杀伤潜能。EGFR在多种晚期实体瘤中呈现高表达状态,MET通路异常也是多种肿瘤疾病的发病机制之一,也是预后不良因素,阻断EGFR和MET通路可对多种晚期实体瘤产生治疗作用。
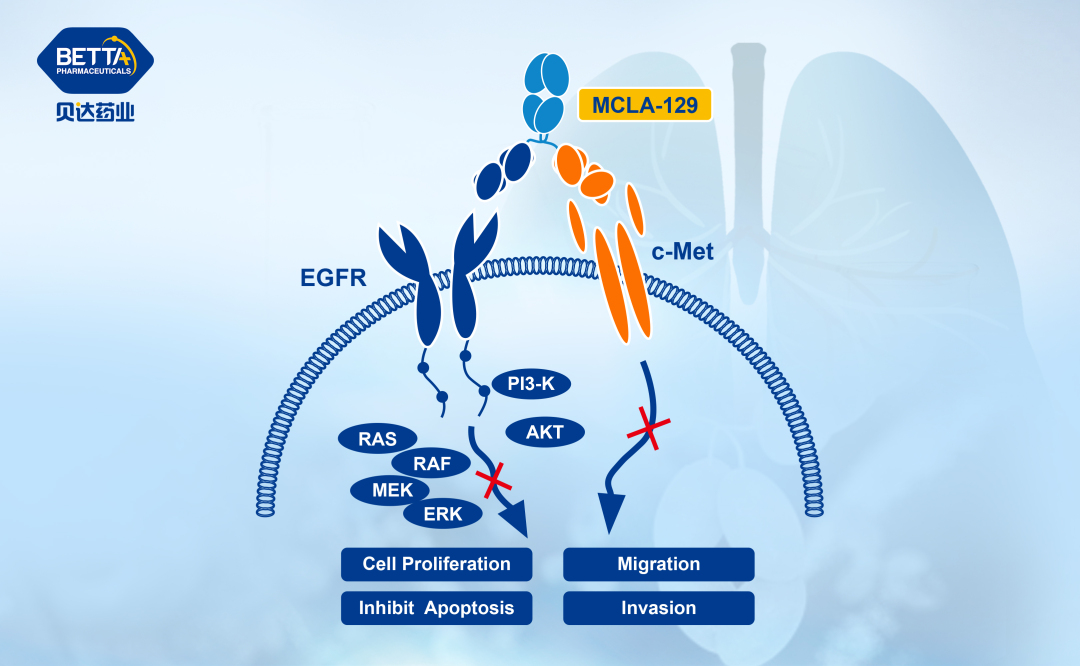
△MCLA-129作用机理图
贝达药业副总裁王三虎表示,此次临床试验的开展,是公司为满足晚期实体瘤治疗领域迫切需求的重要探索,期待注射用MCLA-129在临床试验中取得良好的数据,造福广大患者。
贝达药业副总裁李培麒表示,贝达将继续发挥自身优势,结合前期研究基础,尽快推进项目临床研究开发,为EGFR及MET 通路依赖的晚期实体瘤患者提供更多治疗选择,改善患者的生活质量。
关于MCLA-129
2019年1月,贝达药业与荷兰Merus公司就MCLA-129项目达成战略合作,获得MCLA-129项目在中国的开发和商业化独家授权许可,Merus公司保留中国以外的全球权益。
关于Merus
Merus是一家以肿瘤治疗药物临床开发为核心的公司,拥有开发创新全人源双特异性和三特异性抗体的治疗药物技术平台Multiclonics®。Multiclonics®使用行业标准方法生产制备抗体,并且在临床前和临床研究中发现该平台制备的抗体与常规单克隆抗体有相似的特征,例如,长半衰期和低免疫原性。
下一条: 贝达药业CFT8919胶囊Ⅰ期临床研究首例受试者入组
