近日,美国食品药品监督管理局(Food and Drug Administration;简称FDA)官网公布:贝达药业恩沙替尼临床研究中心符合美国FDA制定的GCP(药物临床试验质量管理规范),顺利通过FDA核查,这是继8月公司及控股子公司Xcovery通过美国FDA的临床BIMO(Bioresearch Monitoring,生物研究监测)相关PAI(Pre-Approval Inspection,批准前检查)现场核查、原料药CMC(Chemical Manufacture and Control,化学、生产与控制)PAI现场核查后,临床核查也顺利通过,标志着恩沙替尼的临床研究符合国际标准,距在美获批上市再近一步。
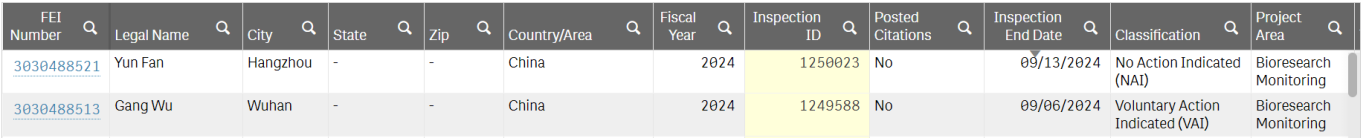
△来源:FDA官网
临床研究是药物研发过程中的一个重要环节,美国FDA针对临床试验研究制定了严格的管理规范,包括临床研究方案执行、数据准确性与完整性、数据的使用都要符合GCP和规范的SOP运行,旨在确保药物的安全性、有效性得到正确评估并且确保受试者的权利和安全得到保护。
FDA检查员于2024年9月2日至9月13 日对恩沙替尼中国的两个临床研究中心进行了现场检查。FDA检查员逐项审阅了监管文件、申办方通信、研究者资质文件、原始病历、实验室报告、病例报告表、试验药品的发放回收记录、储存条件的文件,走访了GCP药房,与PI和研究团队访谈了研究者职责和方案的特定流程。经过10天全面系统的核查,FDA检查员充分肯定临床研究的文件记录的完整性和数据的科学性,认为临床研究中心流程清晰,质量管理严格,试验数据客观真实可靠,实施符合方案要求,主要研究者和研究团队各成员尽职尽责,严谨的工作方式保证临床试验质量,符合美国FDA制定的GCP管理规范,并且对疫情期间研究机构制定的相应管理措施保障了受试者的治疗和数据的完整性和科学性给与中肯的认可。
贝达药业副总裁张惠军表示,这是公司首次迎接美国FDA临床现场核查,也是FDA审评审批的关键环节,国内的两个研究中心顺利通过FDA现场核查,离不开研究中心及贝达研究团队每一位同事的辛勤工作,反映了他们一贯严谨科学的工作作风,也离不开公司的全方位支持。FDA临床现场核查通过标志着恩沙替尼关键审评审批里程碑的达成,期待恩沙替尼早日在美国获批上市。
Xcovery 首席执行官桑凌表示,很高兴恩沙替尼美国的临床研究中心顺利通过核查,作为贝达的首个海外NDA项目,我们将积极推进后续的工作,争取早日取得最后的通行证,造福更多患者。
贝达药业董事长丁列明博士表示,恩沙替尼境内外临床中心都顺利通过FDA现场核查,是贝达药业和临床研究中心一直严格贯彻执行GCP标准的结果,让我们对恩沙替尼在美获批充满信心,也为贝达继续开拓国际市场奠定了坚实基础。未来,公司仍将坚持高标准、严要求,为患者持续提供高品质的新药。
下一条: 贝达药业注射用MCLA-129 晚期实体瘤临床试验获批开展
