
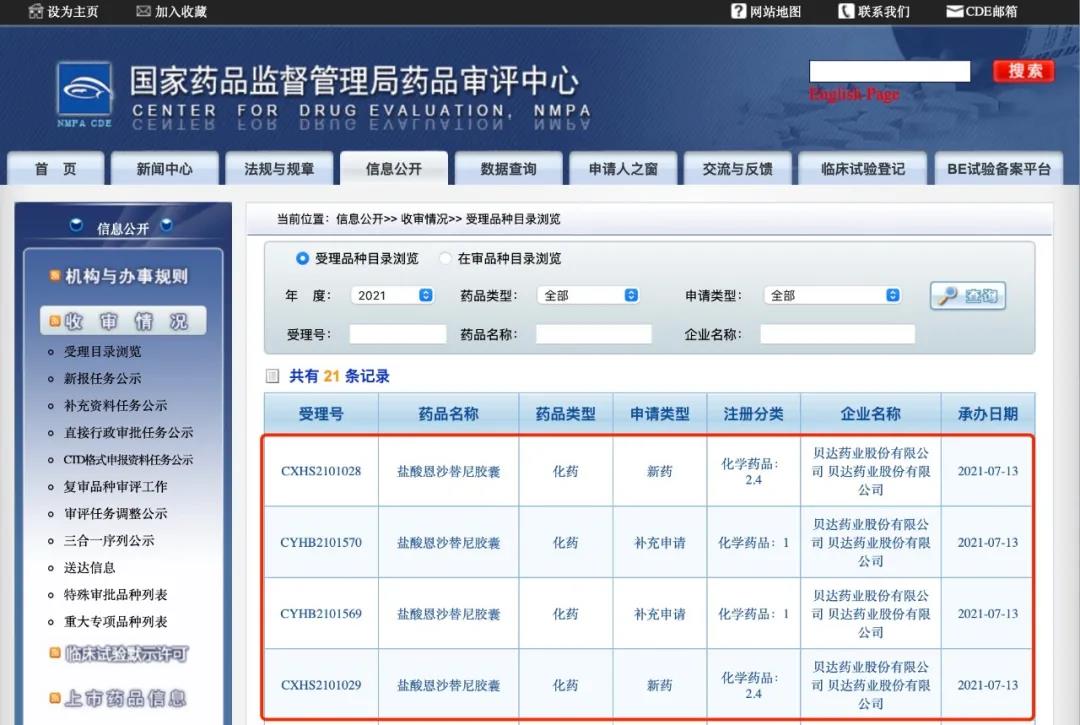
7月13日,贝达药业收到国家药品监督管理局签发的《受理通知书》(受理号:CXHS2101028国、CXHS2101029国),公司申报的盐酸恩沙替尼胶囊(贝美纳®)拟用于 “适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗”的上市许可申请已获得国家药品监督管理局受理。
盐酸恩沙替尼是一种新型强效、高选择性的新一代ALK抑制剂,是贝达药业和控股子公司Xcovery共同开发的全新的、拥有完全自主知识产权的创新药。2020年11月,盐酸恩沙替尼胶囊正式获批上市,获批的适应症为:适用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗(即二线治疗适应症)。恩沙替尼成为中国第一个用于治疗ALK突变晚期非小细胞肺癌的国产1类新药。

本次采用eXalt3研究结果申报一线治疗适应症。eXalt3 研究是一项全球开放多中心随机对照Ⅲ期临床研究,涉及21个国家和地区的123个研究中心,全球总计入组290名患者,中国入组140名患者。试验组为恩沙替尼225mg QD方案,直至疾病进展;对照组为克唑替尼250mg BID方案,直至疾病进展,两组之间不允许交叉。主要研究终点为BIRC评估的ITT人群的mPFS;关键次要研究终点为OS, ORR/DOR (overall and brain), TTF in the brain, QOL (EORTC, LCSS)。
2020年8月,美国范德堡大学Leora Horn博士在世界肺癌大会(IASLC WCLC)主席团研讨会(Presidential Symposium)上首次报告了eXalt3研究结果。2021年1月,广东省人民医院吴一龙教授在2020年世界肺癌大会(WCLC)会上发布了恩沙替尼eXalt3 研究最新数据。
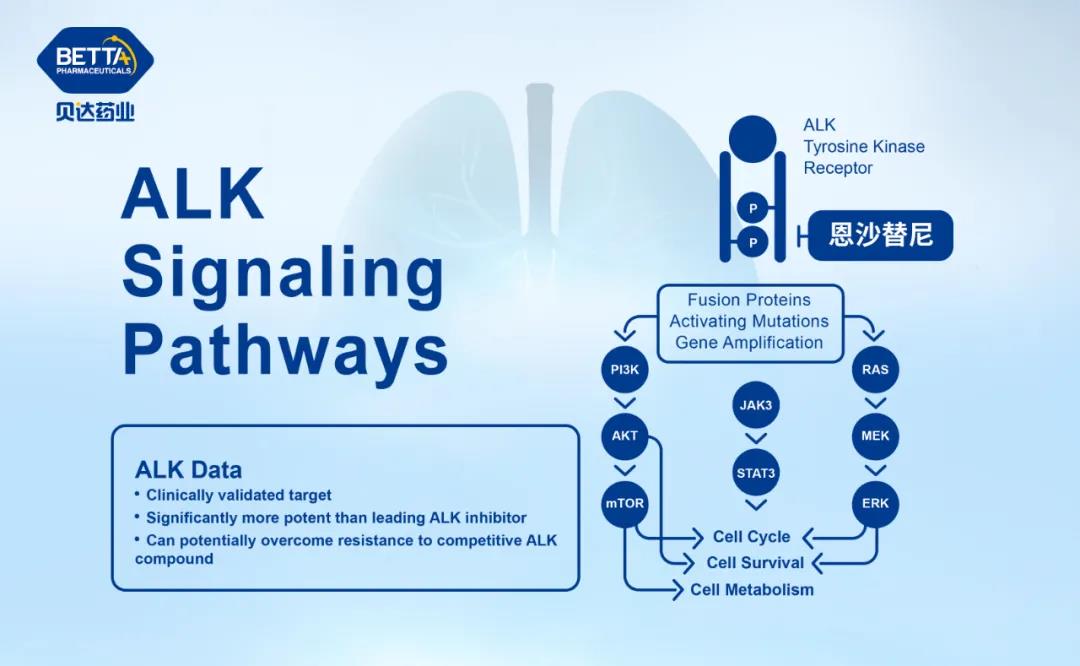
△ 盐酸恩沙替尼作用机理图
研究结果显示,截至2020年12月8日,在意向治疗(ITT)人群中,恩沙替尼组患者的中位PFS(基于独立评审委员会IRC)显著长于克唑替尼组(31.3个月vs12.7个月),而在mITT人群中,恩沙替尼INV评估的中位PFS达到33.2个月,随访中位数为27.6个月。恩沙替尼组2年的OS率为78%,也证实了恩沙替尼组患者OS的良好趋势。患者生活质量随访报告的结果显示恩沙替尼治疗组患者较克唑替尼治疗组患者的生活质量明显改善。
贝达药业副总裁季东表示,eXalt3 研究恩沙替尼PFS显著延长,较克唑替尼显著改善患者生活质量,恩沙替尼是ALK突变晚期非小细胞肺癌患者一线治疗的全新选择。基于eXalt3研究,公司正积极准备美国一线适应症的上市申报,恩沙替尼有望成为首个由中国企业主导在全球上市的肺癌靶向创新药,相信未来成功上市后将会全线出击,在ALK阳性NSCLC患者全程管理中全面守护患者生命。
贝达药业副总裁马勇斌表示,作为公司首个以国际多中心临床数据进行上市申报的项目,项目在进行过程中遇到很多挑战。为此,项目组成员认真研读法规政策,制定了切实可行的注册策略,为顺利申报提供了重要保障。本次注册申请资料多、时间紧、任务重、要求高,贝达药业医学部、注册部等各部门紧密配合,并与Xcovery公司高效联动,全力快速推进项目,提前完成申报,为后续项目积累了丰富的国际多中心临床和注册经验。下一步,我们将竭尽全力做好后续工作,争取恩沙替尼一线适应症早日获批上市,惠及广大患者。
下一条: 贝达药业党委书记、副总裁马勇斌荣获“省优秀共产党员”称号
