
8月9日,贝达药业BPI-361175项目I期临床研究第一例受试者成功入组,顺利完成首次给药。该研究全称为“评价BPI-361175片在晚期实体瘤患者中安全性、耐受性、药代动力学和有效性的剂量递增、开放的I/II期研究”,主要研究者为上海市肺科医院周彩存教授。I期研究包括剂量递增和扩大入组两部分,主要目标是评估BPI-361175针对晚期非小细胞肺癌患者的安全性和耐受性、探索最大耐受剂量(MTD)和剂量限制性毒性(DLTs)、确定后期临床研究推荐剂量,同时评估初步疗效。
BPI-361175 是由贝达药业自主研发的拥有完全自主知识产权的新分子实体化合物,是一种新型强效、选择性的第四代表皮生长因子受体(Epidermal growth factor receptor, EGFR)口服小分子抑制剂,拟治疗携带EGFR C797S突变及接受三代EGFR TKI耐药后的晚期非小细胞肺癌。
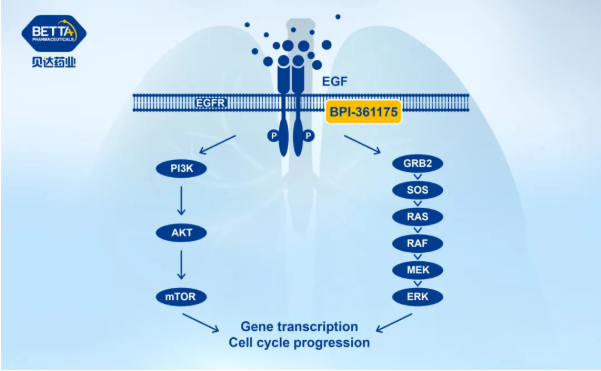
△BPI-361175作用机理图
根据化学药品注册分类改革工作方案公告,BPI-361175为“境内外均未上市的创新药”,其注册分类为化学药品1类。2021年2月,贝达药业收到国家药品监督管理局(NMPA)签发的《药物临床试验批准通知书》(通知书编号: 2021LP00244、2021LP00245),BPI-361175片符合药品注册相关法规要求,同意按照提交的方案开展实体瘤的临床研究。
贝达药业资深副总裁兼首席科学家王家炳博士表示,目前,国内外针对携带 EGFR C797S 突变的药物均处于临床前或早期临床阶段,尚无药物上市。BPI-361175作为新型强效、选择性EGFR小分子口服抑制剂,临床前研究结果显示其具有良好的抗肿瘤活性、安全性、耐受性和药代动力学特征,或可进一步改善耐药、提升疗效,满足迫切的临床需求,期待在与研究机构和专家们的共同努力下,加快推进临床研究进程,争取填补国内空白,为携带EGFR C797S突变及其他EGFR相关突变的患者提供更多益处。
下一条: 贝达药业蝉联“中国医药新锐创新力量”榜首
