近日,贝达药业收到国家药品监督管理局签发的《药品注册证书》(药品批准文号:国药准字H20230011、H20230012),甲磺酸贝福替尼胶囊(赛美纳®)适用于“具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗”适应症获批上市。这是甲磺酸贝福替尼胶囊获批的第二项适应症。
甲磺酸贝福替尼胶囊是针对T790M突变的第三代EGFR-TKI,具有巨大的临床需求。既往临床研究数据被《柳叶刀· 呼吸医学》在编者按中评价:贝福替尼作为EGFR突变的晚期非小细胞肺癌的新候选药物,可作为中国患者新的用药选择。
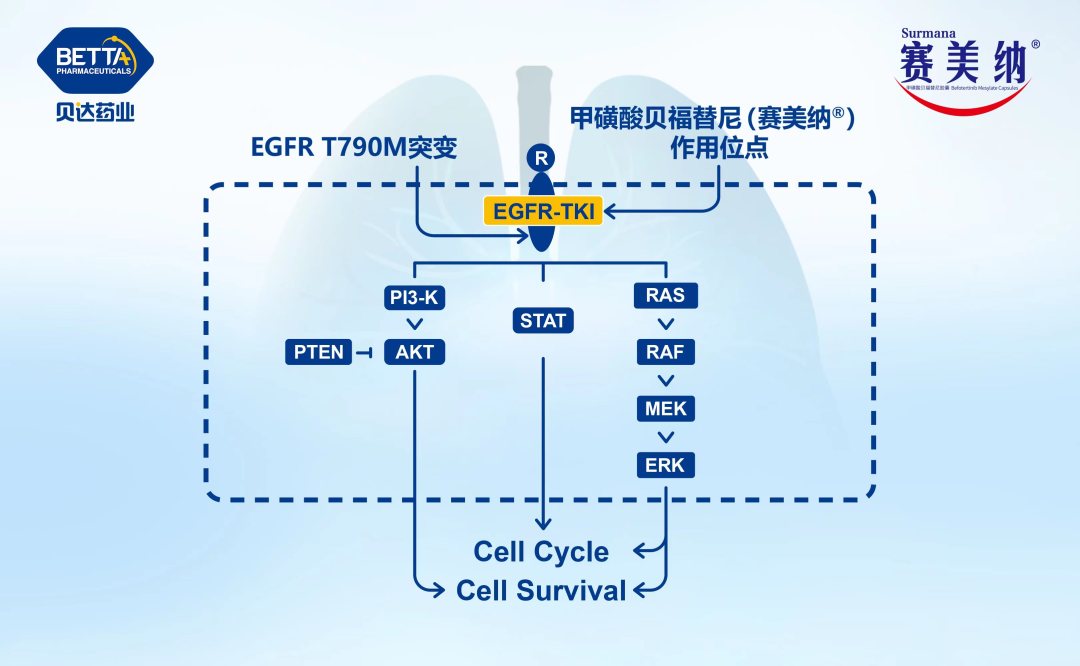
△甲磺酸贝福替尼胶囊作用机理图
本次新适应症获得批准是基于一项随机、对照、多中心、开放性的II/III期研究(IBIO-103),在既往未接受过系统治疗的EGFR敏感突变阳性的局部晚期或转移性NSCLC患者中,评价贝福替尼(75→100 mg)对比埃克替尼(125 mg)的有效性和安全性。研究共纳入362名患者,按1:1随机化分组到贝福替尼组或埃克替尼组。贝福替尼组和埃克替尼组IRC评估的中位PFS分别为22.1个月和13.8个月(HR 0.49, P<0.0001),相较于埃克替尼,贝福替尼可降低51%的疾病进展或死亡风险。在基线脑转移患者中,贝福替尼仍可降低52%的疾病进展或死亡风险(HR 0.48, P=0.0086)。安全性方面,治疗相关的不良事件(TRAEs)主要为1~2级,血小板减少是最常见的TRAE。试验过程中未观察到新的安全性信号。
贝达药业副总裁王三虎表示,国家药品监督管理局对贝福替尼一线适应症的批准不仅是对其临床效果和安全性的进一步认可,也是对中国创新药物研发的鼓励和支持。期待贝福替尼在未来能够帮助更多的肺癌患者战胜病魔,重获新生。
项目主要研究者、上海市胸科医院陆舜教授表示,贝福替尼一线适应症的获批,为医生提供了新的治疗武器,将提升晚期肺癌患者生存质量。期待贝福替尼开展更多临床研究,累积更多临床数据,为中国患者提供更好的治疗指导。
贝达药业董事长丁列明博士表示,贝福替尼一线适应症的获批,离不开监管部门和临床专家长期的支持与帮助,是公司多部门通力协作、辛勤付出的结果,更是贝达在肺癌创新药领域的坚守和传承。期待贝福替尼为更多非小细胞肺癌患者带来福音,公司将继续坚持医药创新,做更多老百姓用得起的新药好药。
下一条: 贝达药业注射用MCLA-129和甲磺酸贝福替尼胶囊联合研究首例受试者入组
