新闻中心 / News Center
贝达药业口服PD-L1抑制剂BPI-371153胶囊药品获批开展临床试验
日期: 2022-01-16
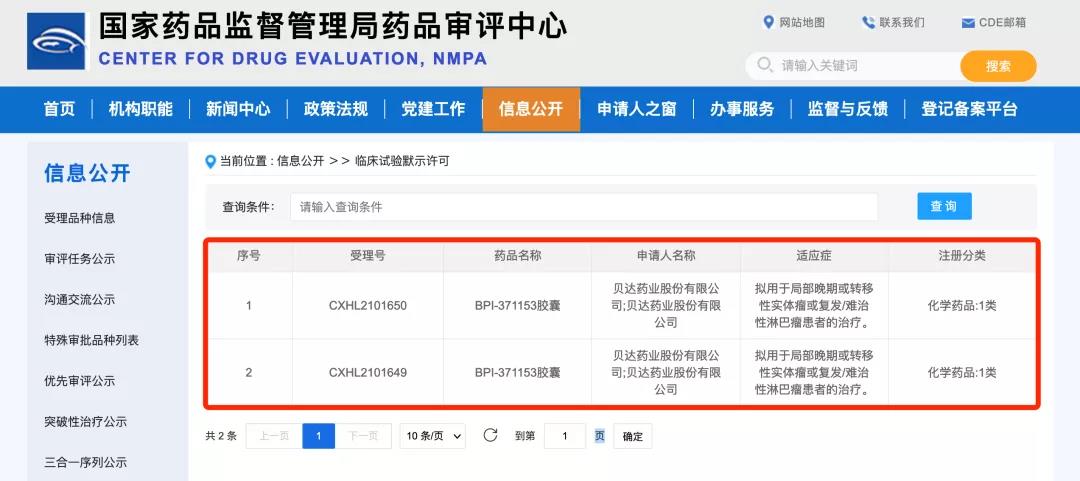
近日,贝达药业收到国家药品监督管理局签发的《药物临床试验批准通知书》(通知书编号:2022LP00057;2022LP00060),公司申报的BPI-371153胶囊的药品临床试验申请已获国家药品监督管理局批准开展。
BPI-371153是由贝达药业自主研发的新分子实体化合物,属于新型强效、高选择性的口服小分子PD-L1(Programmed Cell Death 1 Ligand 1)抑制剂。本品拟用于局部晚期或转移性实体瘤或复发/难治性淋巴瘤患者的治疗。
临床前数据显示,BPI-371153可有效诱导和稳定PD-L1二聚体的形成及内吞,从而强有力地阻断PD-L1/PD-1相互作用。临床前研究中展现出优秀的体外及体内活性、良好的安全性及药代动力学性质。
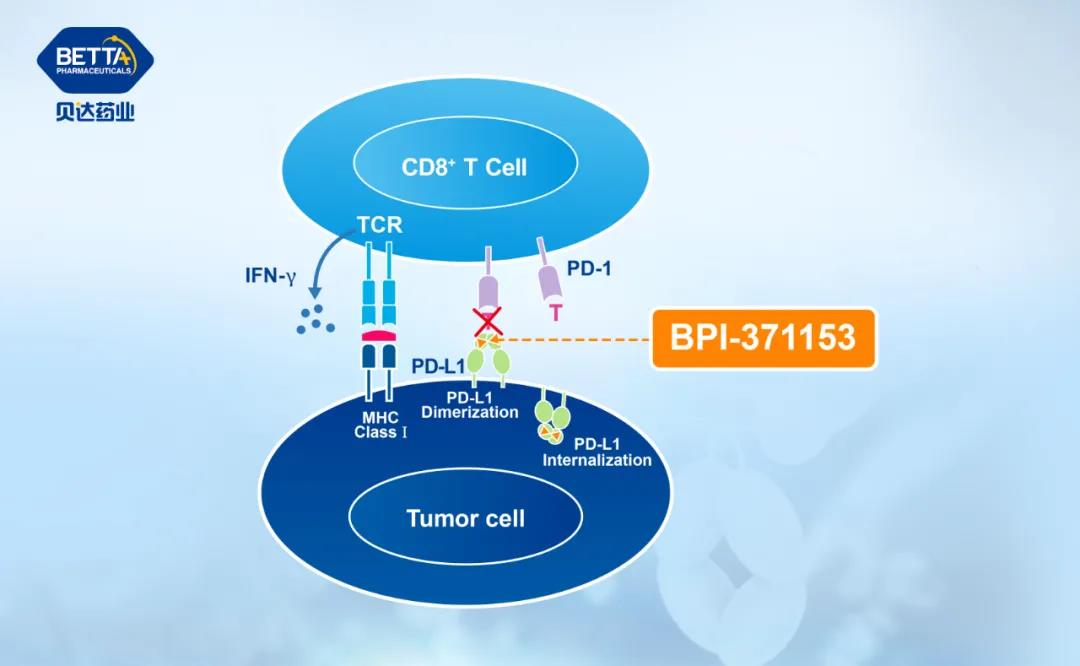
△BPI-371153作用机理图
贝达药业副总裁兼北京研发中心主任兰宏博士表示,截至目前,全球尚无获批或已上市的PD-L1小分子抑制剂,BPI-371153有望成为全球首批上市的小分子PD-L1抑制剂。相较于单克隆抗体,小分子PD-L1抑制剂可口服,提高患者的依从性,在生产工艺、剂型及给药方式等多种层面的研究也较为成熟,且成本低,同时也可避免大分子药物引起的免疫原性反应。其口服给药这一特点,未来在联合用药中将展现出极强的竞争优势,具有巨大的市场潜力。我们将继续做好后续工作,期待BPI-371153能够早日获批上市,惠及患者。
下一条: 贝达药业伏罗尼布片(CM082)上市申请获受理
热门点击
