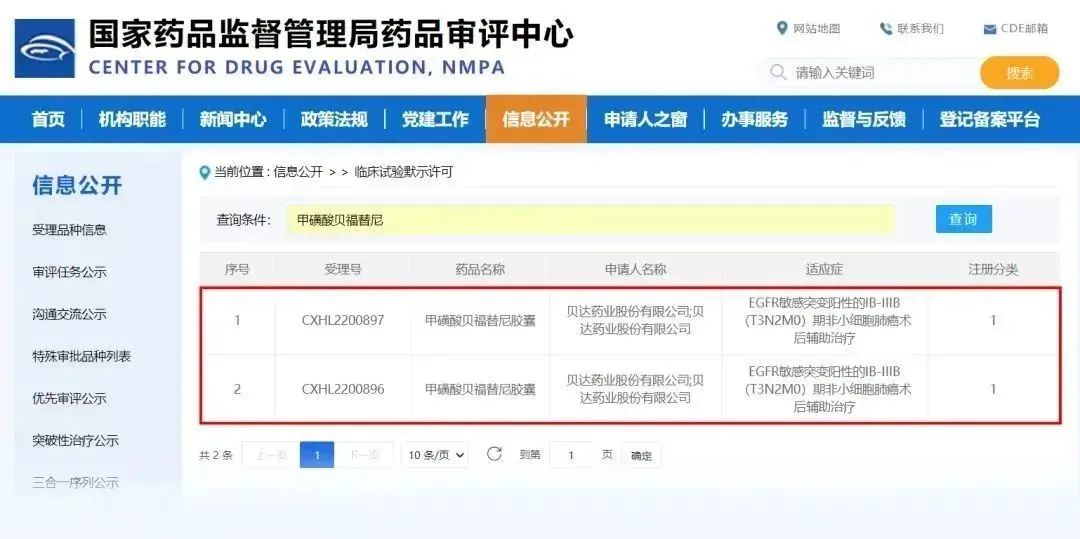
近日,贝达药业收到国家药品监督管理局签发的《药物临床试验批准通知书》(通知书编号:2023LP00192;2023LP00193),公司申报的甲磺酸贝福替尼胶囊拟用于“EGFR敏感突变阳性的IB-IIIB(T3N2M0)期非小细胞肺癌术后辅助治疗”适应症获批开展临床试验。研究设计与贝达药业自主研发的首个国产第一代EGFR抑制剂埃克替尼对照,开展一项随机、双盲、双模拟的III期临床研究。

△甲磺酸贝福替尼胶囊(BPI-D0316)作用机理图
甲磺酸贝福替尼胶囊是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),其NSCLC一线、二线治疗适应症目前均在NDA审评过程中,此次是贝福替尼开展的第三项适应症研究。
贝达药业副总裁季东表示,肺癌术后辅助治疗可以进一步减少复发、延长患者生存,对于EGFR突变阳性的NSCLC患者,EGFR-TKI已成为早期可切除肺癌患者的标准治疗手段。基于此前贝福替尼在NSCLC一线治疗中取得的亮眼成绩,本次研究勇于打破同类第三代EGFR-TKI术后辅助与安慰剂对照的传统局面,研究设计贝福替尼将与权威指南推荐的埃克替尼作为对照,针对NSCLC术后辅助治疗临床试验结果更加值得期待。
贝达药业副总裁王三虎表示,贝福替尼优异的疗效与安全性已在二线、一线NSCLC人群中获得印证,此次NSCLC术后辅助临床试验申请的批准标志着贝福替尼将有希望造福更多EGFR阳性的NSCLC患者,贝达药业将全力推进贝福替尼全线适应症的注册工作,深度发掘更多治疗潜能,期待贝福替尼早日惠及中国广大NSCLC患者。
贝达药业资深副总裁蔡万裕表示,作为国内靶向抗癌药的探路者,贝达药业自主创制的国内首款第一代EGFR-TKI埃克替尼于2011年获批上市,并于2021年再次取得NSCLC术后辅助治疗适应症的批准。此次第三代EGFR-TKI贝福替尼术后辅助适应症临床申请的获批,代表着贝达药业在靶向抗癌创新药领域的又一次传承。
下一条: 贝达药业甲磺酸贝福替尼胶囊(赛美纳®)非小细胞肺癌一线治疗上市申请获受理
