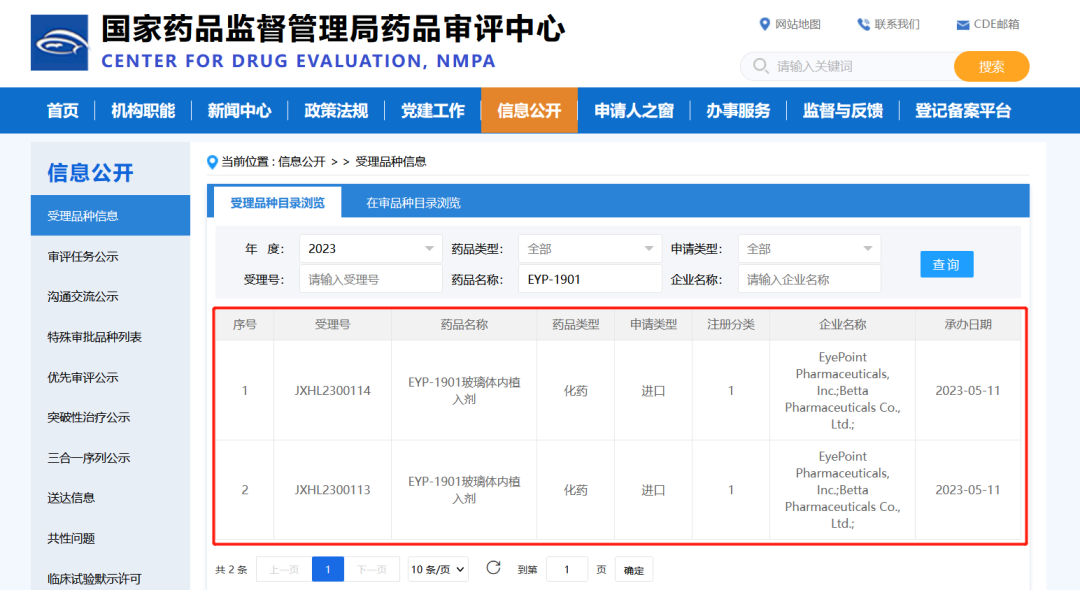
7月27日,贝达药业收到国家药品监督管理局签发的《药物临床批准通知书》(通知书编号:2023LP01498;2023LP01499),公司从EyePoint Pharmaceuticals, Inc.引进的EYP-1901玻璃体内植入剂,拟用于病理性近视脉络膜新生血管(pmCNV)适应症的临床试验申请已获国家药品监督管理局批准。
脉络膜新生血管(CNV)为病理性近视常见的最严重的并发症之一,可引起眼底黄斑区病变,导致中心视力损害,出现中心暗点、视物变形、视野缺损等。血管内皮生长因子(VEGF)的表达上调是造成CNV的主要原因,同时也是CNV 形成引起黄斑区水肿的主要原因。国内外广泛的临床研究及使用情况表明,抗VEGF药物能有效地减轻血管渗漏和抑制眼内新生血管形成,达到调节pmCNV患者视力、减轻后极部组织缺血缺氧等效果。
EYP-1901的活性成份伏罗尼布(贝达药业申报的具有相同活性成份的1类创新药伏罗尼布片已于6月8日获批上市用于治疗肾癌)是新一代多靶点酪氨酸激酶血管内皮生长因子受体(VEGFR)/ 血小板衍化生长因子受体(PDGFR)抑制剂,间歇地抑制VEGFR/PDGFR以达到有效抑制血管生成的作用。pmCNV患者接受短效抗VEGF治疗的疗效稳定后,EYP-1901通过Durasert™缓释给药技术可以使伏罗尼布能够以一种可控和可耐受的方式持续地在眼部释放,延长注射治疗周期,提高患者治疗依从性,减轻医疗负担,并最终改善患者临床效果。
贝达药业副总裁、项目总负责人马勇斌表示,EYP-1901在美国开展的针对湿性年龄相关性黄斑变性的I期临床研究DAVIO中,已表现出了良好的临床潜力。贝达药业期待协同EyePoint,加速推进EYP-1901眼科适应症的临床研究,争取早日上市造福我国眼病患者。
关于EYP-1901
EyePoint的Durasert™技术是一种已批准上市的玻璃体内给药系统。EYP-1901是将伏罗尼布和Durasert技术相结合,形成了一种长效的治疗方案,可用于wAMD、非增生型糖尿病视网膜病变(NPDR)、糖尿病性黄斑水肿(DME)和病理性近视脉络膜新生血管(pmCNV)治疗。Durasert可在门诊办公室通过单次注射给药,4种美国FDA批准的产品已采用该技术,并安全地在数千名患者眼中注射给药。EYP-1901采用EyePoint的可生物降解Durasert给药系统(Durasert E™),并且可以实现约9个月的药物缓释。
下一条: 贝达药业注射用MCLA-129和甲磺酸贝福替尼胶囊联合用药获批开展临床试验
