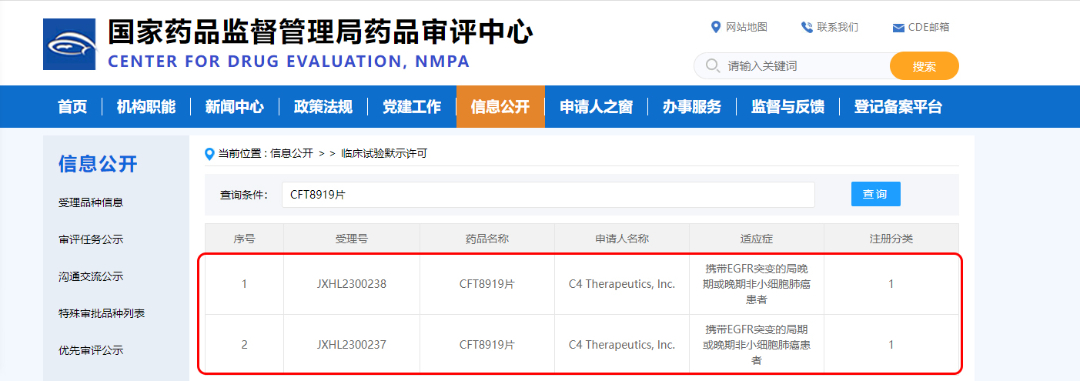
12月4日,贝达药业从C4 Therapeutics, Inc. (C4T)引进的CFT8919片(拟用于携带EGFR突变的非小细胞肺癌)临床试验申请收到国家药品监督管理局签发的《药物临床试验批准通知书》(通知书编号:2023LP02450;2023LP02451)。今年7月,C4T宣布其申报的CFT8919片药品临床试验申请已获美国食品药品监督管理局批准。
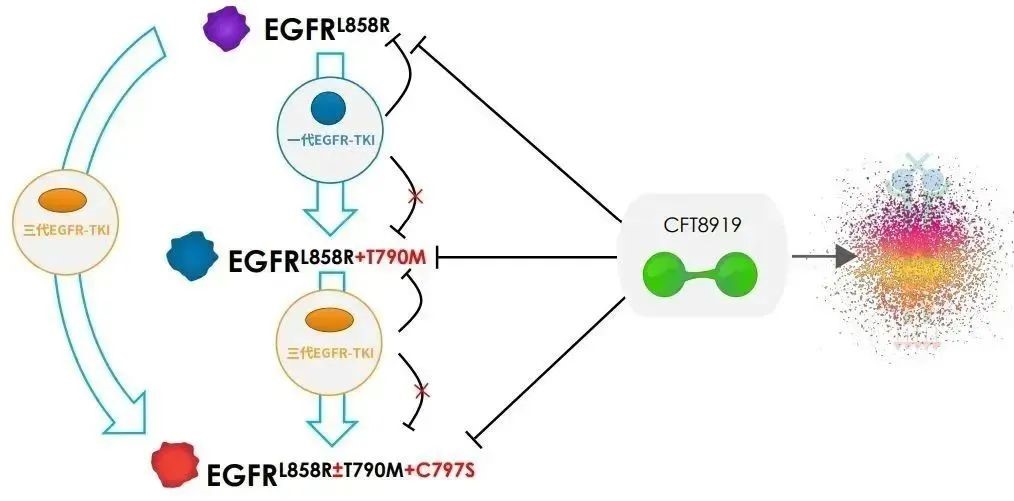
△CFT8919作用机理图(来源:C4T)
CFT8919片是一种具有口服生物利用度的变构 BiDAC™ 降解剂。CFT8919在EGFR L858R驱动的NSCLC的体外和体内模型中具有活性,可靶向EGFR继发性耐药突变,并且具有颅内活性,具有预防或治疗患者脑转移的潜力。
CFT8919通过与L858R突变的变构位点结合,展示出良好的选择性,同时对T790M或C797S突变的EGFR继发耐药突变有效。此外,CFT8919对携带L858R单突变和奥希替尼、厄洛替尼耐药后产生的L858R继发耐药突变,均具有很好细胞增殖抑制活性,同时展示出良好的EGFR野生型选择性。
贝达药业副总裁、项目总负责人王三虎表示,已获批上市的EGFR-TKIs治疗EGFR L858R突变的获益有限,对三代EGFR-TKIs治疗失败或一/二代EGFR-TKIs治疗失败再次活检T790M阴性的患者也缺乏有效的治疗选择,这一治疗需求亟待满足,很高兴看到CFT8919片获批临床,也预示着我们为这一部分肺癌患者带来有效的治疗选择又近了一步。
贝达药业董事长丁列明表示,贝达药业自成立至今,一直致力于创新药物的开发,为更多患者带来高质量、可及的药物,满足肺癌等领域迫切的临床需求。CFT8919片具有重要的临床开发价值,期待CFT8919片随着进一步的研究和开发,能够成为肺癌治疗领域的重要突破,为全球患者提供新的治疗选择,改善患者的生活质量。
下一条: 贝达药业恩沙替尼脑转移IIT研究最新数据亮相2023 ESMO
