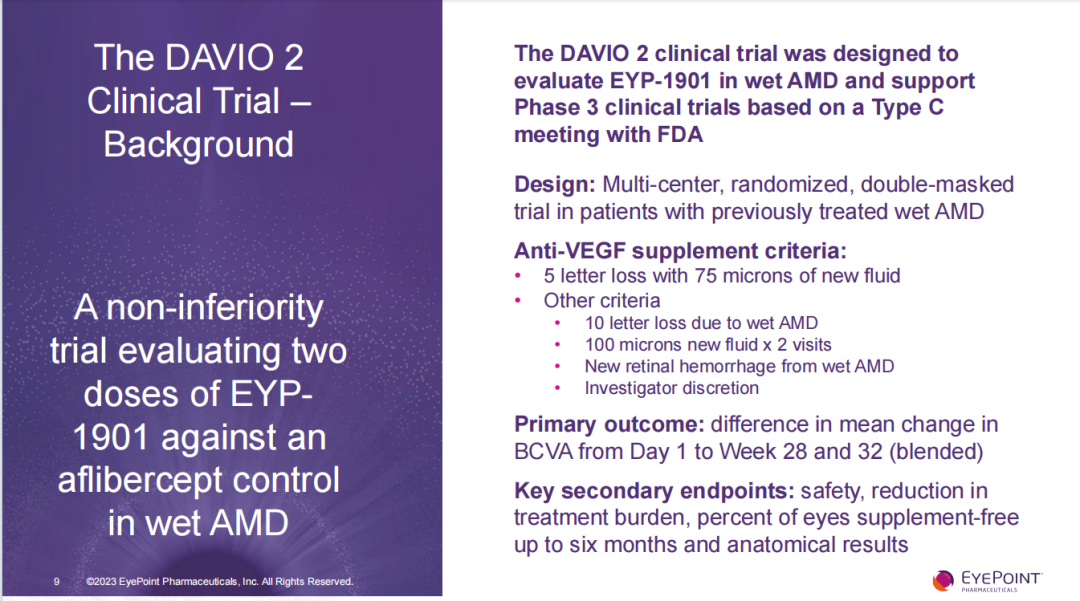
12月4日,Eyepoint Pharmaceuticals(EyePoint)在官网发布新闻[1],EYP-1901治疗湿性年龄相关性黄斑变性(w-AMD)的Ⅱ期临床试验DAVIO 2达到所有主要终点和次要终点。

DAVIO 2是以阿柏西普为对照组,针对先前接受过治疗的w-AMD患者进行随机、双盲Ⅱ期临床试验,旨在探索EYP-1901在w-AMD患者中的疗效和安全性并用以支持启动III期临床试验。所有入组的受试者既往均接受过标准抗血管内皮生长因子(VEGF)治疗,并被随机分配到EYP-1901(2mg或3mg组)或阿柏西普对照组之一。DAVIO 2试验的主要终点是从第一天到第28周和32周最佳矫正视力(BCVA)的平均变化差异;次要终点包括安全性、治疗负担减少程度、6个月内无需补充抗VEGF注射的比例和光学相干断层成像(OCT)测量中心视网膜厚度(CST)的变化。
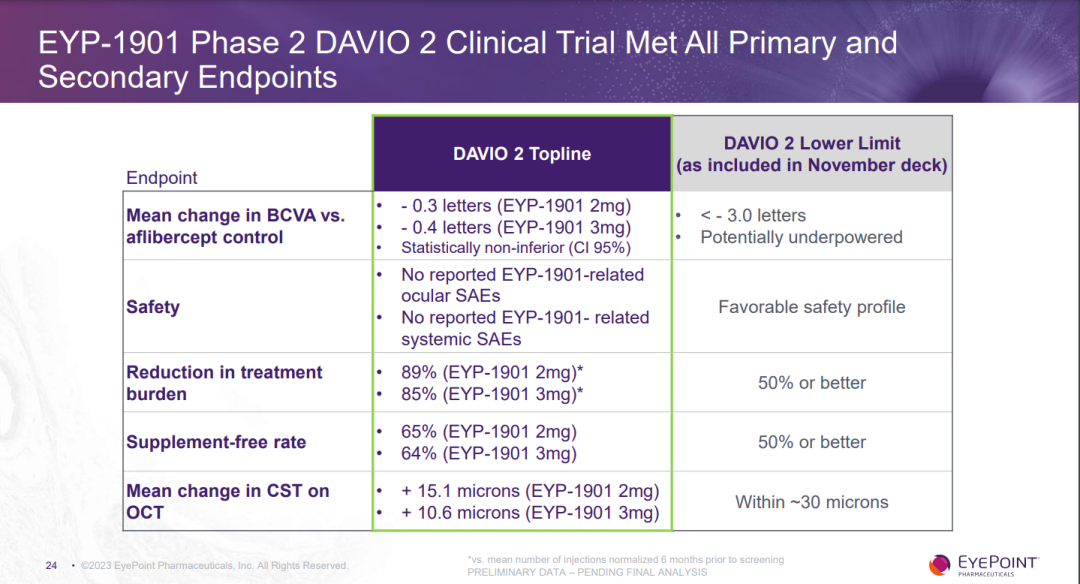
DAVIO 2试验结果包括:
● EYP-1901剂量组(2mg和3mg)都达到了所有主要和次要终点。
● 结合28周和32周的数据,主要终点BCVA的变化对比阿柏西普对照组达到了统计学上的非劣效结论(95% CI):与阿柏西普对照组相比,EYP-1901剂量组(2mg和3mg)分别相差-0.3和-0.4个字母(FDA将非劣效下限定义为-4.5个字母)。
● 维持良好的安全性和耐受性:未发生与EYP-1901相关的眼科或系统严重不良事件(SAE)。
● EYP-1901剂量组(2mg和3mg)的治疗负担(注射频率)分别减少了89%和85%。
● EYP-1901剂量组(2mg和3mg),65%和64%的受试者可以六个月内无需进行抗VEGF补救治疗。
● 在32周时,与阿柏西普对照组相比,EYP-1901剂量组(2mg和3mg)在组织学上均体现出更好的疾病控制能力(OCT下中心视网膜厚度变化低于10微米)。
● 32周前的患者停药率仅4%。
EYP-1901是将伏罗尼布和Durasert®技术相结合,形成的一种新的治疗方案。2020年2月,贝达药业控股子公司Equinox Sciences, LLC(Equinox)独家授权EyePoint在中国(包括香港、澳门和台湾)区域外以局部给药方式开发伏罗尼布用于治疗w-AMD、糖尿病视网膜病变(DR)和视网膜静脉阻塞(RVO)。2022年5月,贝达药业取得在中国(包括香港、澳门和台湾)区域开发和商业化EYP-1901的独家权利,EyePoint保留EYP-1901在全球其他地区的眼科权利。同时,Equinox独家授权EyePoint在中国(包括香港、澳门和台湾)区域外开发伏罗尼布用于所有局部给药的眼科适应症,包括糖尿病黄斑水肿(DME)。
关于EYP-1901
EyePoint的Durasert®技术是一种已批准上市的玻璃体内给药系统,它将另一种药物注射进入玻璃体内后缓释,有效期可长达3年。
EYP-1901是将伏罗尼布和Durasert®技术相结合,形成了一种新的治疗方案,可在门诊办公室注射,EYP-1901可生物降解,并且可以实现约9个月的药物释放。
关于伏罗尼布
伏罗尼布(商品名:伏美纳®)是具有全新化学结构的新一代多靶点酪氨酸激酶血管内皮生长因子受体(VEGFR)/ 血小板衍化生长因子受体(PDGFR)抑制剂,可抑制肿瘤血管生成及生长,可用于治疗病理性血管生成性疾病。2023年6月,伏罗尼布获批上市,其与依维莫司联合,用于治疗既往接受过酪氨酸激酶抑制剂治疗失败的晚期肾细胞癌患者。
[1] 新闻原文及本篇引用数据链接如下:https://investors.eyepointpharma.com/news-releases/news-release-details/eyepoint-pharmaceuticals-announces-positive-topline-data-phase-2
https://investors.eyepointpharma.com/static-files/2f2e6f27-26f6-400f-9e52-a3fec5885ea7
下一条: 贝达药业CFT8919片获批开展临床试验
